Vzťah glykemickej variability a rizikových faktorov diabetu u gravidných žien
Relationship of glycemic variability and diabetes risk factors in pregnant women
The aim of this study was to compare glycemic variability (GV) in pregnant women with and without gestational diabetes mellitus and also to assess the relationship of glycemic variability to risk factors for diabetes. Pregnant women enrolled in the study were divided into a group of women with gestational diabetes mellitus (GDM) and without gestational diabetes mellitus, i.e., the control group (CG), based on the results of the oral glucose tolerance test (oGTT, 2018 Slovak Diabetes Society criteria). After collection of anamnestic, biometric and biochemical parameters, the pregnant women were set up for double-blind 7-day glucose measurement using continuous glucose monitoring (iPro2®Professional CGM).Glycemic variability as expressed by glycemic area under the concentration curve (Total AUC) was statistically significantly higher in women with GDM compared to KS (p = 0,006). The other parameters of glycemic variability [standard deviation, coefficient of variability, J-index, percentage of time spent above the target value of 7.8 mmol/l (%TAR), percentage of time in the target range of 3.5–7.8 mmol/l (%TIR), percentage of time below the target value of 3.5 mmol/l (%TBR)] were not statistically significantly different in the follow-up groups. Diabetes risk factors (positive family history of diabetes, preconception BMI, higher weight gain and higher age at conception) were significantly correlated with glycemic control parameters. In our study, we found that all pregnant women with diabetes risk factors present tended to have higher glycemic variability associated with various feto-uterine complications.
Keywords:
continuous glucose monitoring – gravidity – glycemic compensation – glycemic variability – GDM risk factors
Autoři:
Martina Gáborová 1; Viera Doničová 2
Působiště autorů:
Ústav lekárskej fyziológie LF UPJŠ v Košiciach
1; Interná a diabetologická ambulancia, Košice
2
Vyšlo v časopise:
Diab Obez 2022; 22(43): 9-15
Kategorie:
Pôvodné práce
Souhrn
Cieľom tejto štúdie bolo porovnať glykemickú variabilitu (GV) u tehotných žien s a bez gestačného diabetes mellitus a zároveň posúdiť vzťah glykemickej variability k rizikovým faktorom diabetu. Tehotné ženy zaradené do štúdie boli rozdelené na základe výsledkov orálneho glukózového tolerančného testu (oGTT, kritéria Slovenskej diabetologickej spoločnosti z r. 2018) na skupinu žien s gestačným diabetes mellitus (GDM) a bez gestačného diabetes mellitus, t. j. na kontrolnú skupinu (KS). Po odobratí anamnestických, biometrických a biochemických parametrov boli gravidné ženy nastavené na dvojito zaslepené 7-dňové meranie glykémie pomocou kontinuálneho glukózového monitoringu (iPro2®Professional CGM). Glykemická variabilita vyjadrená glykemickou koncentračnou plochou pod krivkou (Total AUC) bola u žien s GDM štatisticky signifikantne vyššia v porovnaní s KS (p = 0,006). Ostatné parametre glykemickej variability [smerodajná odchýlka, koeficient variability, J-index, percento času stráveného nad cieľovou hodnotou 7,8 mmol/l (% TAR), percento času v cieľovom rozsahu 3,5–7,8 mmol/l (% TIR), percento času pod cieľovou hodnotou 3,5 mmol/l (% TBR)] neboli štatisticky signifikantne rozdielne v sledovaných skupinách. Rizikové faktory diabetu (pozitívna rodinná anamnéza diabetu, predkoncepčný BMI, vyšší hmotnostný prírastok a vyšší vek pri koncepcii) signifikantne korelovali s parametrami glykemickej kontroly. V našej práci sme zistili, že všetky gravidné ženy s prítomnými rizikovými faktormi diabetu mali tendenciu k vyššej glykemickej variabilite, ktorá je asociovaná s rozličnými feto-maternálnymi komplikáciami.
Klíčová slova:
glykemická variabilita – glykemická kompenzácia – gravidita– kontinuálny glukózový monitoring – rizikové faktory GDM
Úvod
Kontinuálne monitorovanie glukózy (CGM – Continuous Glucose Monitoring) poskytuje jedinečný obraz o dennej glykemickej kompenzácii a napomáha lepšie porozumieť vzťahu glykemickej variability a komplikácií diabetu. CGM-sensor aplikovaný do podkožia pomocou tenkého ohybného vlákna (elektródy) zaznamenáva aktuálnu glykémiu približne každých 10 s. Takéto detailné informácie napomáhajú individualizovať terapiu diabetu podľa aktuálnych požiadaviek organizmu [1,2].
CGM je často využívaný u pacientov s diabetes mellitus 1. a 2. typu na rozdiel od gravidných žien s gestačným diabetes mellitus (GDM), o ktorých nachádzame v súvislosti s CGM menšie množstvo klinických štúdií [3].
GDM môžeme definovať ako akýkoľvek stupeň glukózovej intolerancie, ktorý vznikol počas tehotenstva a zvyčajne vymizol krátko po pôrode. Je asociovaný so zvýšenou feto-maternálnou morbiditou ako aj s mnohými krátkodobými (makrosómia plodu, ramienková dystokia, syndróm respiračnej nedostatočnosti, pôrodné poranenia) a dlhodobými komplikáciami (obezita, artériová hypertenzia, neuropsychické poruchy u potomka, diabetes mellitus 2. typu matky) [4].
Pri GDM pozorujeme zníženú sekréciu inzulínu, ktorej hodnota nie je schopná pokryť zvýšené metabolické nároky v gravidite. Porucha sekrécie inzulínu sprevádza nielen GDM, ale aj gravidné so syndrómom polycystických ovárií, obézne gravidné, gravidné s anamnézou predošlého GDM či tehotné s pozitívnou rodinnou anamnézou diabetu [5,6].
Riziko komplikácií GDM rastie proporcionálne so zhoršovaním glykemickej kompenzácie. Na prevenciu týchto komplikácií možno využiť práve podrobný monitoring glykémií a následnú personalizovanú terapiu, keďže je známe, že aj mierne výkyvy glykémie nad normu môžu zapríčiniť epigenetické zmeny, napr. je známa DNA-metylácia [7–10]. Z tohto dôvodu sú glykemické ciele v gravidite veľmi prísne a podliehajú častým úpravám.
Gravidné ženy s novozisteným GDM sa za krátke časové obdobie musia vysporiadať s veľkým množstvom nových informácií, ba dokonca s komplexnou zmenou životného štýlu. Na monitoring glykémií v gravidite sa štandardne využíva selfmonitoring pomocou glukometra, ktorý však ani zďaleka nie je schopný zachytiť všetky glykemické výkyvy [11]. Toto je jedna z príčin, prečo v poslednom období pozorujeme rastúci záujem o CGM aj u gravidných žien s GDM. Viaceré štúdie potvrdili, že CGM umožňuje účinne reagovať na rýchlo sa meniace glykemické pomery v porovnaní so zaužívaným glykovaným hemoglobínom (HbA1c) [12]. Kontinuálny glukózový monitoring totiž ,,vidí” aj za HbA1c, preto má nielen diagnostický, ale aj vedecký prínos [13].
Nedávny medzinárodný konsenzus ATTD (Advanced Technologies & Treatments for Diabetes) v Berlíne stanovil parameter TIR za dôležité parametre glykemickej variability dostupné z CGM. Parametre TIR sú percento času stráveného nad cieľovou hodnotou 7,8 mmol/l (% TAR – Time Above Range), percento času v cieľovom rozsahu 3,5–7,8 mmol/l (% TIR – Time In Range), percento času pod cieľovou hodnotou 3,5 mmol/l (% TBR – Time Below Range) [14].
Metodika
Do štúdie bolo zaradených 23 gravidných žien (20- až 38-ročných) na prelome 2. a 3. trimestra gravidity po záťaži štandardným orálnym glukózovým tolerančným testom (oGTT). Každá žena zaradená do štúdie podpísala informovaný súhlas o účasti v neintervenčnom klinickom skúšaní. Toto klinické skúšanie bolo schválené Etickou komisiou Košického samosprávneho kraja, číslo protokolu 8N/2019. Celý výskum bol realizovaný v súlade so zásadami Helsinskej deklarácie. Na základe výsledku oGTT boli gravidné ženy rozdelené na skupinu žien s gestačným diabetes mellitus (GDM) a bez gestačného diabetes mellitus, t. j. kontrolná skupina (KS). Do skupiny žien s GDM sme zaradili ženy, ktoré spĺňali diagnostické kritériá pre gestačný diabetes mellitus (kritériá Slovenskej diabetologickej spoločnosti, 2018: GDM je diagnostikovaný, ak venózna plazmatická glykémia nalačno ≥ 5,1 mmol/l, po 1. hodine ≥ 10,0 mmol/l, po 2. hodine ≥ 7,8 mmol/l). Ak gravidné nespĺňali uvedené diagnostické kritériá, boli zaradené do kontrolnej skupiny (KS) [15].
Zo štúdie sme vyradili gravidné ženy s diabetes mellitus 1. typu (DM1T), 2. typu (DM2T), so zriedkavými špecifickými typmi DM či so stavmi spojenými s rôznymi pridruženými ochoreniami, ktoré by mohli ovplyvniť výsledky. Následne sme u gravidných žien odobrali anamnestické, biometrické a biochemické parametre. Na rameno nedominantej ruky sme naložili senzor CGM (iPro®2 Professional, Medtronic Diabetes, Northridge, CA, USA) a gravidné poučili o potrebe kalibrácie senzora minimálne 3 razy za deň (nalačno, pred olovrantom a pred spaním). Účastníčky štúdie si zapisovali skonzumované pokrmy a fyzickú aktivitu. Na kalibráciu sme používali glukometer Contour® Link (Bayer, Whippany, NJ, USA). Tri z 23 žien boli vyradené z ďalšej analýzy pre nízky signál CGM senzora, ktorý podmieňoval nepresnosť nameraných glykémií. Presnosť iPro2 CGM bola stanovená použitím optimálnych kritérií presnosti, ktoré boli vypočítane softvérom CGM a dátami z glukometra [16].
Hodnotené parametre glykemickej variability
• total AUC: glykemická koncentračná plocha pod krivkou za 24 hodín v mmol*deň /l (AUC – Area Under Curve)
vzorec na výpočet total AUC:
total AUC = (χ ̅ x n meraní)÷[(84 × n meraní)÷2016]
• AUC nad 7,8: plocha pod hyperglykemickou intersticiálnou koncentračnou krivkou glykémie nad 7,8 mmol/l za 24 hodín a AUC pod 3,5: plocha pod hypoglykemickou intersticiálnou koncentračnou krivkou glykémie pod 3,5 mmol/l za 24 hodín
• priemerná glykémia a štandardná odchýlka (SD – Standard Deviation) ako najbežnejšie parametre získané pri kontinuálnom glukózovom monitoringu
• J-index: alternatívny parameter glykemickej kompenzácie navrhnutý na odhad celkovej kompenzácie diabetu s využitím priemernej glykémie ako aj štandardnej odchýlky vzorec na výpočet:
J-index = 0,001 x (χ ̅ + SD)2
• koeficient variability (% CV): je jeden z najjednoduchších parametrov GV a je definovaný ako pomer štandardnej odchýlky k priemernej glykémii v percentách
vzorec na výpočet:
% CV = SD/χ ̅ x 100
• časové parametre (tab. 1):
• % TIR (Time In Range): percento času stráveného v cieľovom rozsahu 3,5–7,8 mmol/l
• % TAR (Time Above Range): percento času stráveného nad cieľovou hodnotou 7,8 mmol/l
• % TBR (Time Below Range): percento času stráveného pod cieľovou hodnotou 3,5 mmol/l
![Cieľové časové hodnoty pre gravidné s GDM a DM2T. Upravené podľa [14]](https://www.diabetesaobezita.sk/media/cache/resolve/media_object_image_small/media/image_pdf/cc8048f74775ca97dc5600f8d152ffda.jpg)
Demografické charakteristiky súboru a výsledky CGM boli sumarizované vo forme priemerných hodnôt ± SD prípadne percent kategorických premenných. Medián (interkvartilové rozpätie) sme použili na grafické znázornenie celkovej glykemickej koncentračnej plochy pod krivkou (total AUC) v porovnávaných skupinách. Bivariačná analýza (neparametrická Spearmanova korelácia a regresná analýza) bola použitá na posúdenie vzťahu glykemickej variability a rizikových faktorov diabetu vo vyšetrovanom súbore. Dáta boli štatisticky analyzované pomocou programu Stata Special Edition Version 13,1 (StataCorp LP, College Station, TX). Za hranicu štatistickej významnosti sme si zvolili p < 0,05*, na zvýraznenie stupňa závažnosti sme udávali aj úrovne signifikancie p < 0,05*, p < 0,001** (graf 1).

Základnú charakteristiku vyšetrovaného súboru (n = 20) uvádzame prehľadne v tab. 2.
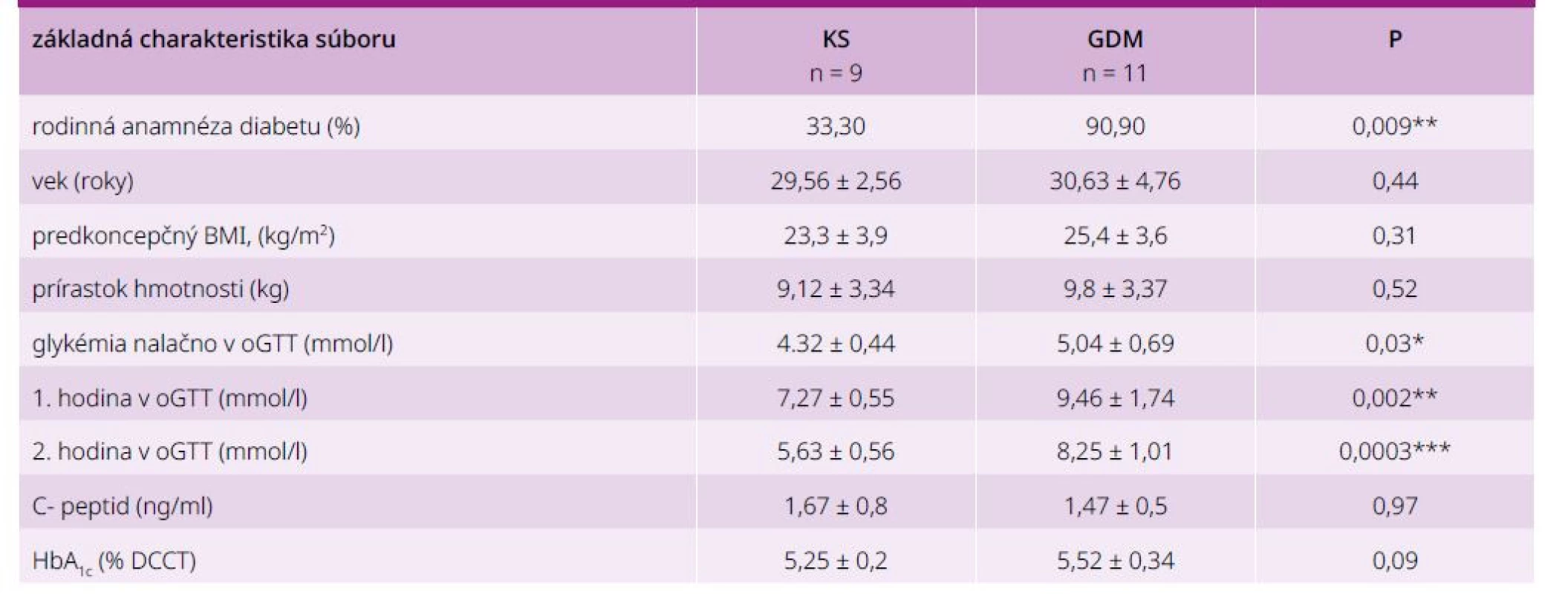
Porovnanie parametrov GV vo vyšetrovaných skupinách (GDM/KS) prehľadne v tab. 3.
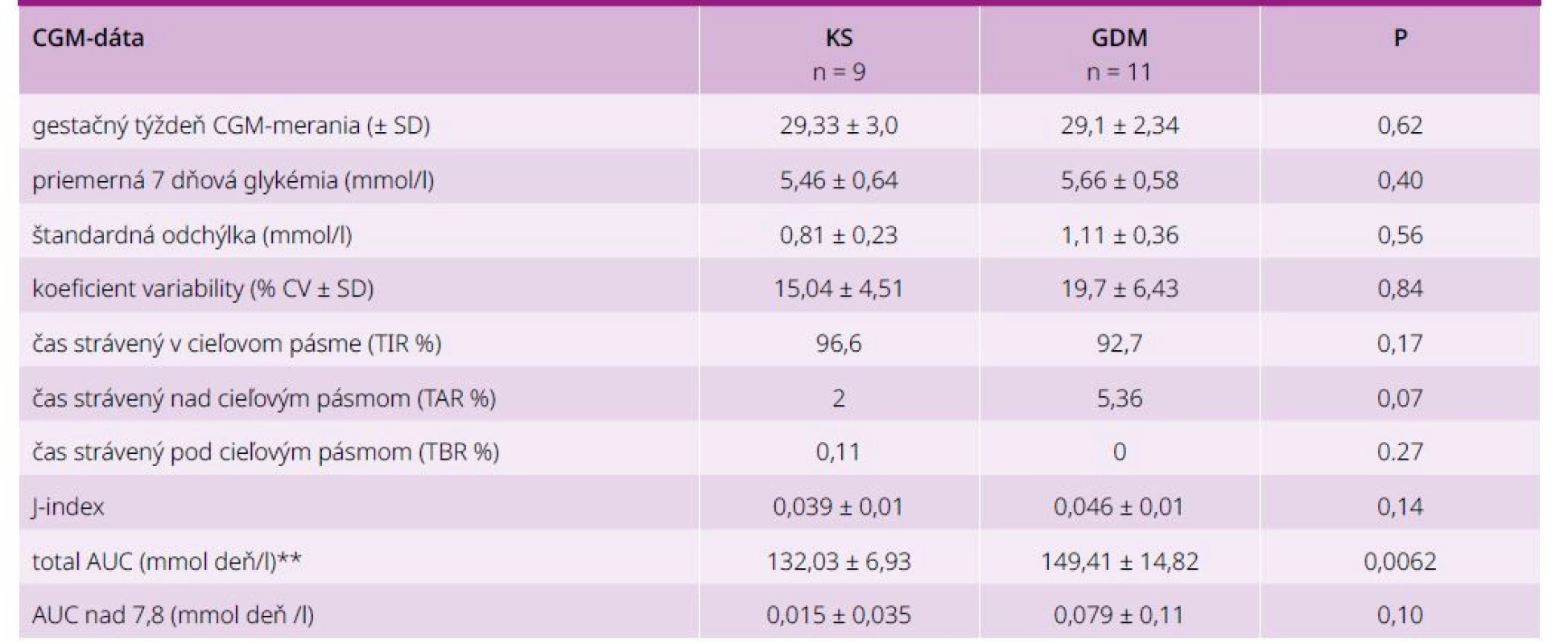
Porovnanie glykemickej variability medzi GDM a KS pomocou total AUC (mmol*deň /l). Total AUC bolo štatisticky signifikantne vyššie u žien s GDM v porovnaní s KS (graf 2).

Výsledky
Vyšetrovaný súbor bol rozdelený do 2 skupín na základe výsledkov oGTT:
• skupina GDM: gravidné s GDM (n = 11); gestačný týždeň 29,1 ± 2,34; vek 30,63 ± 4,76; HbA1c 5,52 ± 0,34 (DCCT), predkoncepčný BMI 28,2 ± 3,13 kg/m2
• kontrolná skupina (KS): gravidné ženy s negatívnym výsledkom oGTT (n = 9); gestačný týždeň 29,33 ± 3,0;, vek 29,56 ± 2,56; HbA1c 5,25 ± 0,2 (DCCT); predkoncepčný BMI 26,5 ± 3,42 kg/m2
Ostatné parametre glykemickej kompenzácie: priemerná glykémia, SD, % CV, % TAR, J-index, AUC nad 7,8 boli vyššie v GDM skupine, avšak nie signifikantne. Priemerné % TIR tehotných s GDM bolo 94,63 %, v kontrolnej skupine 98,17 %. Priemerné % TAR v GDM skupine bolo 5,36 %. Cieľové hodnoty % TAR (< 5 % času nad 7,8 mmol/L) spĺňalo pred dietoterapiou teda len 73 % žien s GDM. Priemerné % TAR v kontrolnej skupine bolo 1,67 %, čo znamenalo výbornú glykemickú kompenzáciu. V GDM skupine sme počas sledovaného týždňa nezaznamenali hypoglykémie pod 3,5 mmol/l, v KS sa vyskytla jedna gravidná s glykémiou pod 3,5 mmol/l.
Pozitívna rodinná anamnéza diabetu bola prítomná v 91 % prípadov žien s GDM, v KS to bolo 33,3 % prípadov. Rodinná anamnéza diabetu štatisticky signifikantne korelovala s total AUC (mmol* deň/l; p = 0,019) ako aj s glykémiou nalačno v orálnom glukózovom tolerančnom teste (p = 0,035). Predkoncepčné BMI korelovalo s GV vyjadrenou % TAR (p = 0,054). Vyšší hmotnostný prírastok v tehotenstve signifikantne koreloval s koeficientom variability (p = 0,030). Vyšší vek tehotných (≥ 30 rokov) negatívne koreloval s dosiahnutím cieľových hodnôt, t. j. % TIR (p = 0,003), avšak pozitívne s % TAR (p = 0,003) a AUC nad 7.8 (mmol* deň/l; p = 0,042), tab. 4.
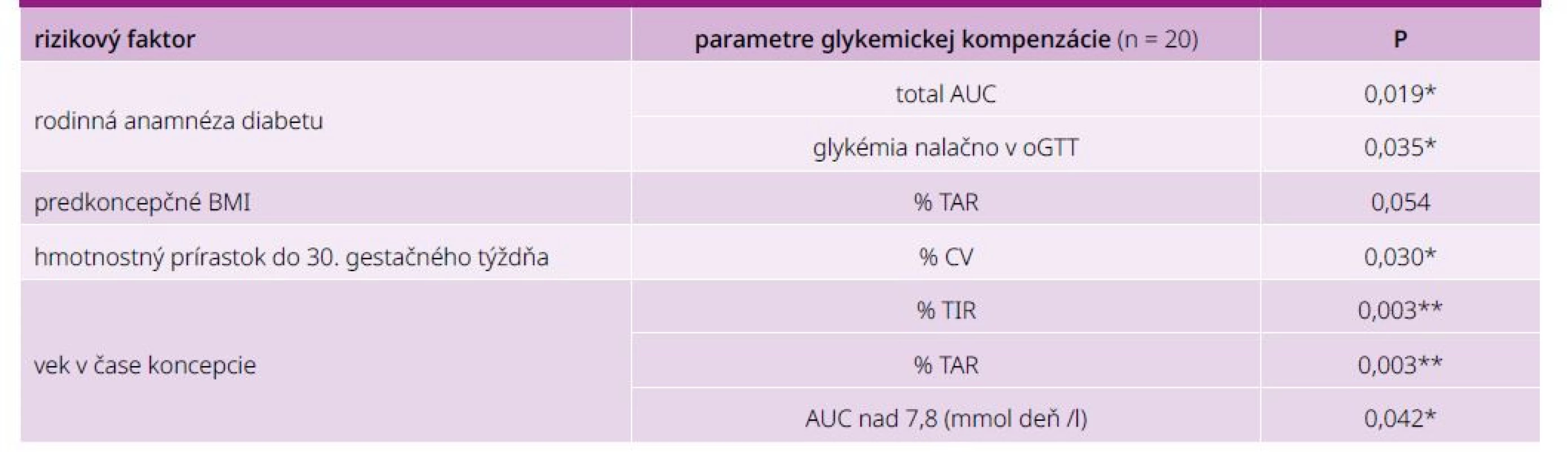
Na štatistické hodnotenie bol použitý neparametrický test Spearmanovej korelácie.
Diskusia
Parametre GV vs HbA1c v gravidite
Primárnym cieľom tejto štúdie bolo porovnať glykemickú variabilitu (získanú kontinuálnym glukózovým monitoringom) u gravidných žien s GDM a bez neho. Pozorovali sme signifikantne vyššiu GV vyjadrenú ako total AUC v skupine žien s GDM. Vysvetľujeme si to tým, že total AUC vyjadruje nielen trvanie a rozsah glykémií, ale aj závažnosť hyperglykémie. Štandardne využívaný HbA1c sa v sledovaných skupinách gravidných žien (GDM/KS) nelíšil. Tento fakt je konzistentný s nedávnou štúdiou zaoberajúcou sa diagnostikou GDM. Štúdia poukázala na fakt, že glykovaný hemoglobín mal pre diagnostiku GDM nízku spoľahlivosť a nedostatočnú senzitivitu a špecificitu [19]. Podobný výsledok priniesla skupina štúdií, ktorá porovnávala diagnostiku GDM glykovaným hemoglobínom a štandardným oGTT [18]. Zopár štúdií protikladne popisuje vysokú efektivitu HbA1c pri diagnostike GDM, hodnoty plochy pod krivkou sa pohybovali v rozmedzí 0,805 až 0,937 [20–22].
HbA1c odráža 3-mesačnú koncentráciu glukózy v krvi, nie je však schopný vyjadriť komplexnosť glykemickej kompenzácie, predpovedať riziko komplikácií diabetu a už vonkoncom nie zachytiť akútnu glykemickú dynamiku [23].
Pozorovali sme, že parametre TIR boli lepšími prediktormi GV v gravidite v porovnaní s bežne využívaným koeficientom variability, štandardnou odchýlkou či priemernou glykémiou.
To potvrdzuje aj štúdia Vigersky et al, ktorá predpokladá, že % TIR, % TAR a % TBR sú jedny z najdôležitejších parametrov GV [24]. TIR parametre môžu byť úspešne využívané na hodnotenie glykemických výkyvov, účinnosti terapie a času stráveného v tzv. ,,bezpečnej” zóne [12].
Porovnanie CGM a selfmonitoringu v gravidite
Selfmonitoring glykémii je dôležitým diagnostickým a terapeutickým nástrojom pri starostlivosti o gravidné ženy s GDM, avšak jeho správne využitie vyžaduje pochopenie určitých limitov tejto metódy (napr. presnosť meraní).
Pochopiteľne existuje mnoho dôkazov o tom, že CGM je schopné zachytiť aj výkyvy, ktoré sa bežným selfmonitoringom nepodarí zachytiť, a tak sa javí ako účinnejší diagnostický nástroj v porovnaní so selfmonitoringom [3,25].
Rodinná anamnéza diabetu
Rodinná anamnéza diabetu v našej štúdii pozitívne korelovala s GV (total AUC) čo si vysvetľujeme súvislosťou s genetickou predispozíciou k inzulínovej rezistencii, resp. insenzitivite. Literatúra uvádza, že výskyt diabetu u prvostupňových príbuzných je jeden z najdôležitejších rizikových faktorov pre rozvoj GDM. Irving et al popísali 31% prevalenciu GDM v prípade pozitivity rodinnej anamnézy diabetu v tehotenstve [26].
Predkoncepčný BMI
Vyšší predkoncepčný BMI je rizikový faktor, ktorý spolu so sedavým spôsobom života a excesívnym prírastkom hmotnosti v gravidite vytvárajú ideálne podmienky pre vyššiu glykemickú variabilitu [27]. Vyšší predkoncepčný BMI je spájaný aj s rôznymi komplikáciami pre matku a jej potomka (makrosómia novorodenca), čo pravdepodobne súvisí s nízkou koncentráciou adiponektínu [28]. Niektoré štúdie dokonca predpokladajú asociáciu nízkeho plazmatického adiponektínu s neskorším rozvojom GDM [29,30]. Našťastie, predkoncepčný BMI, resp. nadváha až obezita pred graviditou sú jednými z mála modifikovateľných rizikových faktorov [31].
Hmotnostný prírastok v gravidite
Excesívny hmotnostný prírastok v gravidite je asociovaný s predčasný pôrodom, makrosómiou plodu ako aj s rastovou retardáciou plodu [32]. Odporúčania odborných spoločností o normálnom hmotnostnom prírastku v jednotlivých trimestroch gravidity sa opierajú o predkoncepčný BMI a sledovanie rôznych popôrodných ukazovateľov. Bolo dokázané, že riziko makrosómie plodu u gravidných s DM1T a exscesívnym prírastkom hmotnosti je až 42 % v porovnaní gravidnými s DM1T, ktoré dosiahli odporúčaný hmotnostný prírastok [33].
Vek pri koncepcii
U gravidných žien po 30. roku života sme pozorovali vyššiu GV (% TIR, % TAR, AUC nad 7,8). Vek pri koncepcii je jeden z najviac študovaných rizikových faktorov GDM. Štúdia vedená v Iráne a Bahraine popísala vek pri koncepcii ako jeden z najdôležitejších rizikových faktorov asociovaných s GDM [34]. Viacero štúdií potvrdilo signifikantne vyššie riziko vzniku GDM u gravidných žien vo vekovej kategórií nie nad 30, ale nad 35 rokov (OR 2,63; 95% CI 2,4–2,89).
Pomocou metodiky CGM sa nám podarilo odhaliť GV u žien s GDM, ktorú sme neboli schopní zachytiť bežnými metódami (selfmonitoring a pod). Parametre glykemickej variability získané z dát CGM korelovali s viacerými rizikovými faktormi GDM. Možno teda predpokladať, že vyšší počet rizikových faktorov bude sprevádzaný vyššou GV so všetkými dobre aj menej známymi dôsledkami.
Naša štúdia bola limitovaná niekoľkými faktormi, napr. ,,fyziologickou medzerou” teda oneskorením intersticiálnej glykémie asi o 10–15 minút za sérovou hodnotou, možnou chybovosťou glukometra či pomerne malým súborom gravidných žien.
Záver
V našej práci sme vďaka parametru total AUC potvrdili signifikantný rozdiel v glykemickej variabilite u gravidných žien s a bez GDM. Rutinne používaný parameter glykemickej kompenzácie (HbA1c) nevykazoval signifikantný rozdiel vo vyšetrovaných skupinách. Ukazovatele TIR sa blížili k hranici signifikancie. Tieto zistenia poukazujú na vyššiu presnosť a detailnosť údajov získaných z kontinuálneho glukózového monitoringu v porovnaní s rutinnými vyšetreniami. Podarilo sa nám potvrdiť asociáciu medzi vyššou glykemickou variabilitou a rizikovými faktormi GDM (pozitívna rodinná anamnéza diabetu, vyšší vek gravidných, vyšší predkoncepčný BMI a vyšší hmotnostný prírastok). U gravidných žien s prítomnosťou jedného alebo viacerých rizikových faktorov teda možno predpokladať vyššiu GV so všetkými feto- maternálnymi komplikáciami. Dobrou správou však je, že predkoncepčný BMI a hmotnostný prírastok patria k ovplyvniteľným rizikovým faktorom. Nadváha alebo obezita pred plánovanou graviditou podobne ako aj hmotnostný prírastok v gravidite (najmä excesívny býva spojený s inzulínovou insenzitivitou a predčasným vyčerpaním B-buniek) by mali viesť k preventívnym opatreniam, ktoré by znížili riziko vzniku GDM prípadne riziko vysokej GV pri vzniknutom GDM [36].
Článok vyšiel s podporou Slovenskej diabetologickej spoločnosti (grant č. 9201 9000).
Doručené do redakcie | Received 28. 2. 2022
Prijaté po recenzii | Accepted 3. 4. 2022
MUDr. Martina Gáborová, PhD.
www.upjs.sk
Zdroje
1. Kropff J, Bruttomesso D, Doll W et al. Accuracy of Two Continuous Glucose Monitoring Systems: A Head-to-Head Comparison under Clinical Research Centre and Daily Life Conditions. Diabetes Obes Metab 2015; 17(4): 343–349. Dostupné z DOI: <http://dx.doi.org/10.1111/dom.12378>.
2. Rodbard D. Continuous Glucose Monitoring: A Review of Successes, Challenges, and Opportunities. Diabetes Technol Ther 2016; 18(Suppl 2): S3–S13. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2015.0417>.
3. Yu Q, Aris IM, Tan KH et al. Application and Utility of Continuous Glucose Monitoring in Pregnancy: A Systematic Review. Front Endocrinol (Lausanne) 2019; 10: 697. Dostupné z DOI: <http://dx.doi.org/10.3389/fendo.2019.00697>.
4. Kautzky-Willer A, Harreiter J, Winhofer-Stockl Y et al. Gestational Diabetes Mellitus (Update 2019). Wien Klin Wochenschr 2019; 131(Suppl 1): 91–102. Dostupné z DOI: <http://dx.doi.org/10.1007/s00508–018–1419–8>.
5. Sawada M, Masuyama H, Hayata K et al. Pregnancy Complications and Glucose Intolerance In Women With Polycystic Ovary Syndrome. Endocr J 2015; 62(11): 1017–1023. Dostupné z DOI: <http://dx.doi.org/10.1507/endocrj.EJ15–0364>.
6. Yu HF, Chen HS, Rao DP et al. Association between Polycystic Ovary Syndrome and the Risk of Pregnancy Complications: A Prisma-Compliant Systematic Review and Meta-Analysis. Medicine 2016; 95(51): E4863. Dostupné z DOI: <http://dx.doi.org/10.1097/MD.0000000000004863>.
7. Gatti M. Feasibility of Freestyle Libre Flash Glucose Monitoring System in Pregnant Woman Affected by Type 1 Diabetes. Acta Diabetol 2019; 56(4): 481–483. Dostupné z DOI: <http://dx.doi.org/10.1007/s00592–018–1252–6>.
8. Tyndall V, Stimson RH, Zammitt NN et al. Marked Improvement in HbA1c Following Commencement of Flash Glucose Monitoring in People with Type 1 Diabetes. Diabetologia 2019; 62(8): 1349–1356. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–019–4894–1>.
9. Vlachova Z, Bytoft B, Knorr S et al. Increased metabolic risk in adolescent offspring of mothers with type 1 diabetes: The Epicom Study. Diabetologia 2015; 58(7): 1454–1463. Dostupné z DOI: <http://dx.doi.org/10.1007/s00125–015–3589–5>.
10. Miao M, Dai M, Zhang Y et al. Influence of maternal overweight, obesity and gestational weight gain on the perinatal outcomes in women with gestational diabetes mellitus. Sci Rep 2017; 7(1): 305. Dostupné z DOI: <http://dx.doi.org/10.1038/s41598–017–00441-z>.
11. Law GR, Ellison GT, Secher AL et al. Analysis of continuous glucose monitoring in pregnant women with diabetes: Distinct Temporal patterns of glucose associated with large-for-gestational-age infants. Diabetes Care 2015; 38(7): 1319–1325. Dostupné z DOI: <http://dx.doi.org/10.2337/dc15–0070>.
12. Danne T, Nimri R, Battelino T et al. International Consensus on Use of Continuous Glucose Monitoring. Diabetes Care 2017; 40(12): 1631–1640. Dostupné z DOI: <http://dx.doi.org/10.2337/dc17–1600>.
13. Kramer G, Michalak L. Association between flash glucose monitoring and metabolic control as well as treatment satisfaction in outpatients with diabetes type 1. Exp Clin Endocrinol Diabetes 2019; 129(4): 303–308. Dostupné z DOI: <http://dx.doi.org/10.1055/a-0875–3988>.
14. Battelino T, Danne T, Bergenstal RM et al. Clinical Targets for Continuous Monitoring Data Interpretation: Recommendations from the international consensus on time in range. Diabetes Care 2019; 42(8): 1593–1603. Dostupné z DOI: <http://dx.doi.org/10.2337/dci19–0028>.
15. Martinka E. Diagnostika diabetes mellitus. Forum Diab 2018; 7(Suppl 1): 15–17.
16. Mastrototaro JJ. The Minimed Continuous Glucose Monitoring System. Diabetes Technol Ther 2000; 2(Suppl 1): S13–S18. Dostupné z DOI: <http://dx.doi.org/10.1089/15209150050214078>.
17. Wojcicki JM. “J”-Index. A New proposition of the assessment of current glucose control in diabetic patients. Horm Metab Res 1995; 27(1): 41–42. Dostupné z DOI: <http://dx.doi.org/10.1055/s-2007–979906>.
18. Panyakat WS, Phatihattakorn C, Sriwijitkamol A et al. Correlation between third trimester glycemic variability in non-insulin-dependent gestational diabetes mellitus and adverse pregnancy and fetal outcomes. J Diabetes Sci Technol 2018; 12(3): 622–629. Dostupné z DOI: <http://dx.doi.org/10.1177/1932296817752374>.
19. Rayis DA, Ahmed AB, Sharif ME et al. Reliability of glycosylated hemoglobin in the diagnosis of gestational diabetes mellitus. J Clin Lab Anal 2020; 34(10): e23435. Dostupné z DOI: <http://dx.doi.org/10.1002/jcla.23435>.
20. Kwon SS, Kwon JY, Park YW et al. Hba1c for diagnosis and prognosis of gestational diabetes mellitus. Diabetes Res Clin Pract 2015; 110(1): 38–43. Dostupné z DOI: <http://dx.doi.org/10.1016/j.diabres.2015.07.014>.
21. Dubey D, Kunwar S. Mid-Trimester Glycosylated Hemoglobin Levels (Hba1c) and its correlation with oral glucose tolerance test (World Health Organization 1999). J Obstet Gynaecol Res 2019; 45(4): 817–823. Dostupné z DOI: <http://dx.doi.org/10.1111/jog.13916>.
22. Ryu AJ, Moon HJ, Na JO et al. The usefulness of the glycosylated hemoglobin level for the diagnosis of gestational diabetes mellitus in the korean population. Diabetes Metab J 2015; 39(6): 507–511. Dostupné z DOI: <http://dx.doi.org/10.4093/dmj.2015.39.6.507>.
23. Yu W, Wu N, Li L et al. A review of research progress on glycemic variability and gestational diabetes. Diabetes Metab Syndr Obes 2020; 13: 2729–2741. Dostupné z DOI: <http://dx.doi.org/10.2147/DMSO.S261486>.
24. Vigersky RA, Shin J, Jiang B et al. The Comprehensive Glucose Pentagon: A Glucose-Centric Composite Metric for Assessing Glycemic Control in Persons with Diabetes. J Diabetes Sci Technol 2018; 12(1): 114–123. Dostupné z DOI: <http://dx.doi.org/10.1177/1932296817718561>.
25. Zaharieva DP, Teng JH, Ong ML et al. Continuous Glucose Monitoring Versus Self-Monitoring of blood glucose to assess glycemia in gestational diabetes. Diabetes Technol Ther 2020; 22(1): 822–827. Dostupné z DOI: <http://dx.doi.org/10.1089/dia.2020.0073>.
26. Irving RR, Mills JL, Choo-Kang EG et al.The Burden of Gestational Diabetes Mellitus in Jamaican Women with a Family History of Autosomal Dominant Type 2 Diabetes. Rev Panam Salud Publica 2008; 23(2): 85–91. Dostupné z DOI: <http://dx.doi.org/10.1590/s1020–49892008000200003>.
27. Barros GM, Figueiredo LD, Souza PA et al. Risk Factors for Constant Glycemic Variability in Pregnant Women: A Case-Control Study. Rev Bras Enferm 2020; 73(Suppl 5): e20180983. Dostupné z DOI: <http://dx.doi.org/10.1590/0034–7167–2018–0983>.
28. Heerman WJ, Bian A, Shintani A et al. Interaction between Maternal Prepregnancy Body Mass Index and Gestational Weight Gain Shapes Infant Growth. Acad Pediatrics 2014; 14(5): 463–470. Dostupné z DOI: <http://dx.doi.org/10.1016/j.acap.2014.05.005>.
29. Ranheim T, Haugen F, Staff AC et al. Adiponectin is reduced in gestational diabetes mellitus in normal weight women. Acta Obstet Gynecol Scand 2004; 83(4): 341–347. Dostupné z DOI: <http://dx.doi.org/10.1111/j.0001–6349.2004.00413.x>.
30. Saisho Y, Miyakoshi K, Ikenoue S et al. Marked Decline in Beta Cell Function during Pregnancy Leads To the Development of Glucose Intolerance In Japanese Women. Endocr J 2013; 60(4): 533–539.
31. Cyganek K, Hebda-Szydlo A, Skupien J et al. Glycemic control and pregnancy outcomes in women with type 2 diabetes from Poland. The impact of pregnancy planning and a comparison with Type 1 Diabetes Subjects. Endocrine 2011; 40(2): 243–249. Dostupné z DOI: <http://dx.doi.org/10.1007/s12020–011–9475–0>.
32. Persson M, Pasupathy D, Hanson U et al. Birth Size Distribution in 3,705 Infants Born to Mothers with Type 1 Diabetes: A Population-Based Study. Diabetes Care 2011; 34(5): 1145–1149. Dostupné z DOI: <http://dx.doi.org/10.2337/dc10–2406>.
33. Scifres CM, Feghali MN, Althouse AD et al. Effect of Excess Gestational Weight Gain on Pregnancy Outcomes in Women with Type 1 Diabetes. Obstet Gynecol 2014; 123(6) 1295–1302. Dostupné z DOI: <http://dx.doi.org/10.1097/AOG.0000000000000271>.
34. Rajab KE, Issa AA Hasan ZA et al. Incidence of Gestational Diabetes Mellitus in Bahrain from 2002 to 2010. Int Fed Gynaecol Obstet 2012; 117(1): 74–77. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijgo.2011.11.013>.
35. Somani B, Arora M, Bhatia K et al. A Comparative Study of the Different Diagnostic Criteria of Gestational Diabetes Mellitus and its Incidence. Med J Armed Forces India 2012; 68(1): 6–11. Dostupné z DOI: <http://dx.doi.org/10.1016/S0377–1237(11)60124-X>.
36. Hedderson MM, Gunderson EP, Ferrara A. Gestational Weight Gain and Risk of Gestational Diabetes Mellitus. Obstet Gynecol 2010; 115(3): 597–604. Dostupné z DOI: <http://dx.doi.org/10.1097/AOG.0b013e3181cfce4f>.
Štítky
Diabetologie ObezitologieČlánek vyšel v časopise
Diabetes a obezita

2022 Číslo 43
Nejčtenější v tomto čísle
- Liečba biosimilárnym inzulínom v bežnej klinickej praxi na Slovensku: kazuistiky
- Vzťah glykemickej variability a rizikových faktorov diabetu u gravidných žien
- Kardiovaskulárny efekt agonistov GLP1-receptorov: metaanalýzy poukazujú na skupinový efekt
- Použitie inhibítorov SGLT2 u diabetikov 2. typu v rôznych fázach kardiovaskulárneho kontinua
